UDI krok po kroku
UDI krok po kroku
Od 26 maja 2021 roku na części etykiet i opakowań wyrobów medycznych pojawią się specjalne kody. Kolejne będą umieszczane stopniowo – aż do 2025 roku. Dzięki temu rozwiązaniu, służącemu do oznaczania i identyfikacji urządzeń medycznych w łańcuchu dostaw opieki zdrowotnej, poprawi się bezpieczeństwo samych pacjentów. Wszystko w ramach tzw. UDI.
UDI to skrót od angielskiego „Unique Device Identification”, czyli od Unikalnej Identyfikacji Wyrobów Medycznych. W praktyce: jest to numeryczne albo alfanumeryczne oznaczenie, wygenerowane przy wykorzystaniu globalnie akceptowanego standardu w zakresie identyfikacji i kodowania. Jak dokładnie ma to być wdrażane? Odpowiedź poniżej.
Czemu ma służyć UDI ?
W dużym skrócie: UDI to uzgodniony na całym świecie system identyfikacji wyrobów medycznych. Dzięki jego ujednoliceniu, wyeliminowane powinny zostać różnice, które wynikają z różnych uwarunkowań prawnych obowiązujących w różnych państwach.
Wprowadzając ład w oznaczeniach, UDI ma przynieść korzyści producentom, użytkownikom/pacjentom, a także urzędom. Na dłuższą metę ma to poprawić bezpieczeństwo pacjentów, podnieść jakość opieki zdrowotnej, a także usprawnić procesy biznesowe z zakresu ochrony zdrowia.
UDI – jak to ma wyglądać krok po kroku
Wdrażanie UDI w praktyce sprowadza się do trzech kroków. Najpierw należy przypisać unikalny identyfikator UDI do urządzeń medycznych – chodzi o UDI-DI (GTIN) + UDI-PIs (IZ). Kolejny krok to zamieszczenie UDI na wyrobie medycznym (na etykiecie, opakowaniu). Może to nastąpić zarówno w formie czytelnej dla człowieka, jak i na właściwym nośniku danych. Co ważne, należy zastosować „bezpośrednie oznaczenie” na urządzeniach wielokrotnie wykorzystywanych. I wreszcie trzeci, ostatni krok: należy przesłać wymagane dane do bazy danych regulatorów UDI.
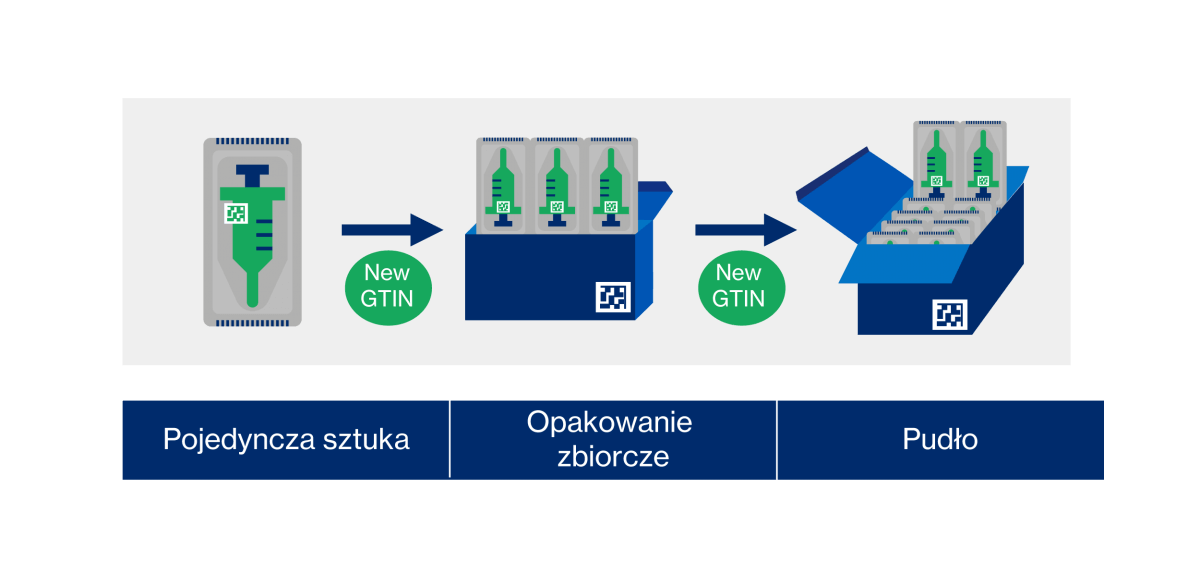
GS1 a UDI
System standardów GS1 jest nastawiony na wspieranie wszystkich zainteresowanych stron w skutecznej i wydajnej realizacji wymagań UDI. Ujednolicone zasady sprzyjają sprawnemu wdrożeniu Unikalnej Identyfikacji Wyrobów Medycznych na całym świecie. Pomaga w tym ponad 2700 pracowników GS1 – to dzięki nim użytkownicy otrzymują wsparcie w zakresie wdrażania UDI w językach ojczystych poszczególnych państw. Pomagają oni także zrozumieć lokalne wymagania związane z tym procesem.
Rozporządzenia Unii Europejskiej stanowiły podstawę do wprowadzenia podstawowego identyfikatora wyrobu Basic UDI-DI, czyli kluczowego elementu pozwalającego na łączenie różnych modułów Europejskiej Bazy Danych o Wyrobach Medycznych. Właśnie w tym celu GS1 stworzyła nowy identyfikator – jest nim GMN, czyli Globalny Numer Modelu. Umożliwia on użytkownikom jednoznaczną identyfikację modelu wyrobu. Jest to możliwe przez cały cykl jego „życia” – od projektu, przez produkcję, zaopatrzenie, użytkowanie i konserwację, aż po usuwanie.
UDI nośniki i formaty danych
UDI-DI jest niepowtarzalnym kodem numerycznym, który można umieścić na różnych nośnikach danych. Mogą to być różnego rodzaju kody. Wszystkie są odczytywane maszynowo, bo technologia AIDC, która za to odpowiada, jest wykorzystywana do automatycznego zbierania danych. Technologie AIDC obejmują kody kreskowe, karty chipowe, biometrię i RFID.
Przykładowo: podawanie dat musi się odbywać zgodnie ze specyfikacjami GS1 – w formacie: RRMMDD. Tę kwestię narzuca Amerykańska Agencja ds. Żywności i Leków. Chodzi tu o różne daty – przede wszystkim daty produkcji, ważności. Między dniem, miesiącem i rokiem muszą się pojawić myślniki.

Zobacz jak IBCS Poland może pomóc przy wdrożeniu standardów UDI w procesie etykietowania
Pobierz
Pobierz


Materiał opracowany przy współpracy z GS1 – oficjalną agencją akredytowaną przez FDA oraz przez KE, odpowiedzialną za nadawanie identyfikatorów UDI jak i wdrożenie standardów UDI na terenie naszego kraju.
