Co zmieni się w przepisach dotyczących wyrobów medycznych
Co zmieni się w przepisach dotyczących wyrobów medycznych
Producenci wyrobów medycznych będą zobowiązani do stosowania na nich nowych oznaczeń. Na etykietach i opakowaniach pojawią się specjalne kody. Wynika to z przepisów, dotyczących tzw. UDI, czyli Unikalnej Identyfikacji Wyrobów Medycznych.
Chodzi tu o system, mający szczególny wpływ na łańcuch dostaw w obszarze opieki zdrowotnej. Ma służyć zarówno do oznaczania, jak i identyfikacji medycznych urządzeń. I to w globalnym wymiarze tego typu działalności.
UDI o co w tym chodzi ?
Przepisy dotyczące UDI zostały opracowane przez Amerykańską Agencję do spraw Żywności i Leków, Komisję Europejską, a także inne światowe organy regulacyjne. Ich celem jest zwiększenie bezpieczeństwa pacjentów, podniesienie jakości opieki zdrowotnej oraz usprawnienie procesów biznesowych z zakresu szeroko pojętej ochrony zdrowia. W realizacji tych zadań w wymiarze globalnym ma zadbać właśnie system UDI.
Komisja Europejska postawiła na GS1
Decyzją Komisji Europejskiej, identyfikatory UDI nadaje GS1, czyli neutralna organizacja non-profit zajmująca się opracowywaniem i wdrażaniem globalnych standardów łańcucha dostaw w ochronie zdrowia. Identyfikatory GS1 pełnią istotną rolę w poprawnej identyfikacji wyrobów medycznych. Sprawdzają się na każdym etapie wspomnianego łańcucha dostaw.
W tym przypadku mówimy o doświadczonej agencji. Od 2013 roku GS1 zajmuje się nadawaniem identyfikatorów UDI w Stanach Zjednoczonych. Niedawno taką akredytację przyznała jej także Komisja Europejska (stało się to 10 czerwca 2019 roku).
GS1 a UDI
System standardów GS1 jest nastawiony na wspieranie wszystkich zainteresowanych stron w skutecznej i wydajnej realizacji wymagań UDI. Ujednolicone zasady sprzyjają sprawnemu wdrożeniu Unikalnej Identyfikacji Wyrobów Medycznych na całym świecie. Pomaga w tym ponad 2700 pracowników GS1 – to dzięki nim użytkownicy otrzymują wsparcie w zakresie wdrażania UDI w językach ojczystych poszczególnych państw. Pomagają oni także zrozumieć lokalne wymagania związane z tym procesem.
Rozporządzenia Unii Europejskiej stanowiły podstawę do wprowadzenia podstawowego identyfikatora wyrobu Basic UDI-DI, czyli kluczowego elementu pozwalającego na łączenie różnych modułów Europejskiej Bazy Danych o Wyrobach Medycznych. Właśnie w tym celu GS1 stworzyła nowy identyfikator – jest nim GMN, czyli Globalny Numer Modelu. Umożliwia on użytkownikom jednoznaczną identyfikację modelu wyrobu. Jest to możliwe przez cały cykl jego „życia” – od projektu, przez produkcję, zaopatrzenie, użytkowanie i konserwację, aż po usuwanie.
UDI – kiedy zacznie obowiązywać w Unii Europejskiej?
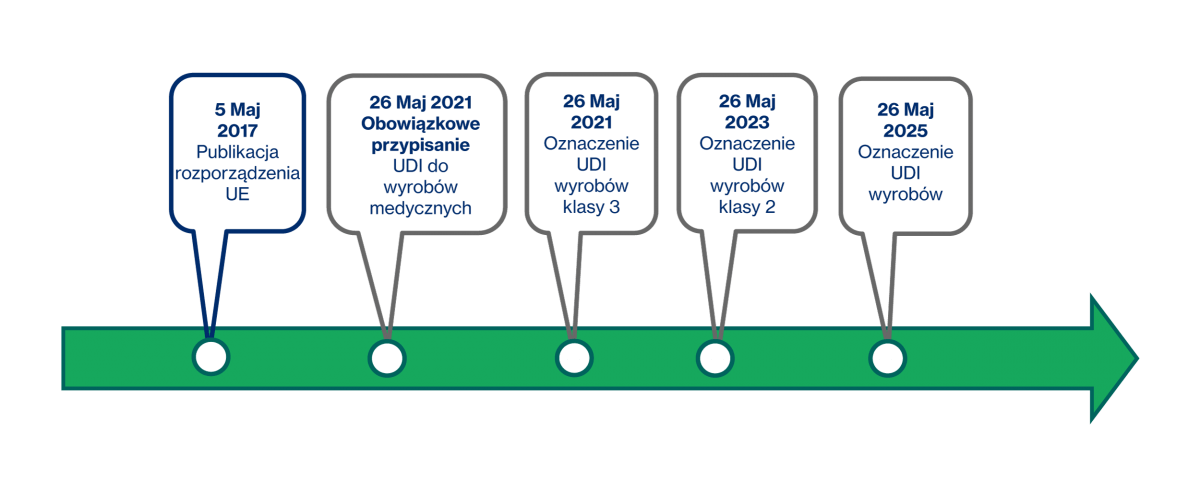
Komisja Europejska podała terminy, w których poszczególne wymogi dotyczące UDI zaczną obowiązywać. Różnice będą zależne od poszczególnych klas danych wyrobów. Obowiązek umieszczania kodów na medycznych etykietach i opakowaniach zacznie obowiązywać najwcześniej 26 maja 2021 roku.
Termin 26 maja 2021 roku obowiązuje w przypadku wyrobów klasy III. Dla wyrobów klasy IIa i IIb to 26 maja 2023 roku. Natomiast dla wyrobów klasy I – 26 maja 2025 roku. Właśnie od tych terminów UDI musi obowiązkowo pojawiać się na etykietach poszczególnych wyrobów.
Zobacz jak IBCS Poland może pomóc przy wdrożeniu standardów UDI w procesie etykietowania
Pobierz
The Sultriest Swimsuits
Let your weekend getaways take care of themselves – we’ve got you and your assets covered.


Materiał opracowany przy współpracy z GS1 – oficjalną agencją akredytowaną przez FDA oraz przez KE, odpowiedzialną za nadawanie identyfikatorów UDI jak i wdrożenie standardów UDI na terenie naszego kraju.
